Aifa, report vaccini Covid: le segnalazioni gravi corrispondono al 17,8% del totale

La distribuzione delle segnalazioni per tipologia di vaccino ricalca le precedenti: Comirnaty 66,5%, Vaxzevria 17,7%, Spikevax 14,5%, COVID-19 vaccino Janssen 1,3%, Nuvaxovid 0,03%
L’Agenzia Italiana del Farmaco ha pubblicato l’undicesimo Rapporto di farmacovigilanza sui vaccini anti-COVID-19 (clicca qui per scaricare il report completo). I dati raccolti e analizzati riguardano le segnalazioni di sospetta reazione avversa registrate nella Rete Nazionale di Farmacovigilanza tra il 27 dicembre 2020 e il 26 marzo 2022 per i cinque vaccini in uso nella campagna vaccinale in corso.
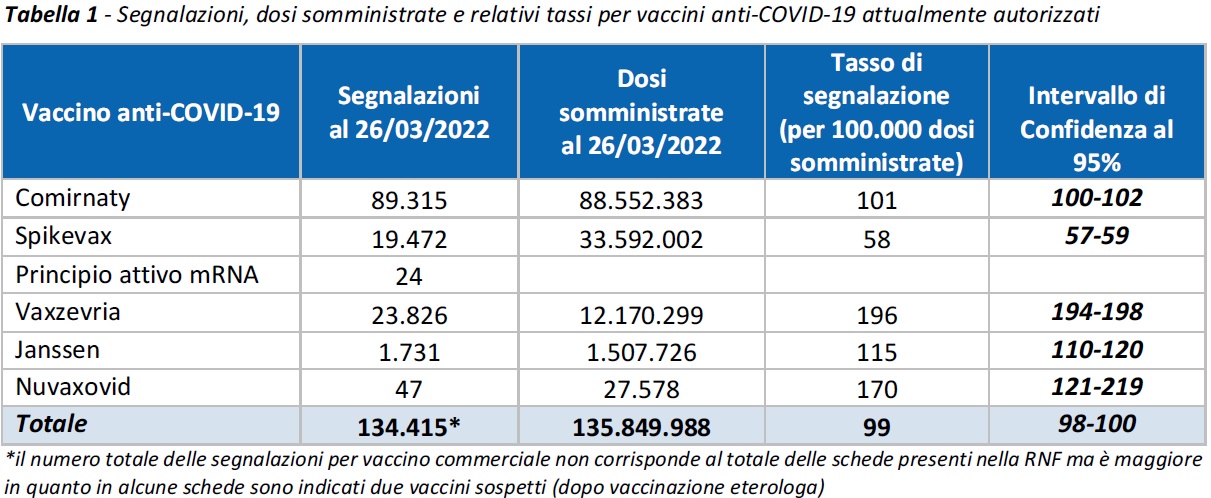
Nel periodo considerato sono pervenute 134.361 segnalazioni su un totale di 135.849.988 di dosi somministrate (tasso di segnalazione di 99 ogni 100.000 dosi), di cui l’82,1% riferite a eventi non gravi, come dolore in sede di iniezione, febbre, astenia/stanchezza, dolori muscolari.
pubblicità
I tassi di segnalazione relativi alla 2a dose sono inferiori a quelli relativi alla 1a e ancora più bassi per la 3a dose. La popolazione esposta alla 4a dose è ancora limitata. Le segnalazioni gravi corrispondono al 17,8% del totale, con un tasso di 18 eventi gravi ogni 100.000 dosi somministrate. Come riportato nei precedenti Rapporti, indipendentemente dal vaccino, dalla dose e dalla tipologia di evento, la reazione si è verificata nella maggior parte dei casi (72% circa) nella stessa giornata della vaccinazione o il giorno successivo e solo più raramente oltre le 48 ore.
Comirnaty è il vaccino attualmente più utilizzato nella campagna vaccinale italiana (65,2%), seguito da Spikevax (24,7%), Vaxzevria (9,0%), COVID-19 Vaccino Janssen (1,1%) e Nuvaxovid (0,02%), in uso dal 28 febbraio 2022. La distribuzione delle segnalazioni per tipologia di vaccino ricalca quella evidenziata nei precedenti Rapporti: Comirnaty 66,5%, Vaxzevria 17,7%, Spikevax 14,5%, COVID-19 vaccino Janssen 1,3%, Nuvaxovid 0,03%.
Per tutti i vaccini, gli eventi avversi più segnalati sono febbre, stanchezza, cefalea, dolori muscolari/articolari, brividi, disturbi gastro-intestinali, reazioni vegetative, stanchezza, reazione locale o dolore in sede di iniezione.
Nella fascia di età 5-11 anni, al 26/03/2022 risultano inserite complessivamente 439 segnalazioni (circa lo 0,3% delle segnalazioni totali) per il vaccino Comirnaty, l’unico attualmente utilizzato in questa fascia di età, con un tasso di segnalazione di circa 21 casi ogni 100.000 dosi. Gli eventi avversi più frequentemente segnalati sono stati dolore in sede di iniezione, cefalea, febbre e stanchezza. La quasi totalità di queste segnalazioni è attribuita alla prima dose.
Il dettaglio
Rispetto al precedente rapporto annuale che copriva l’arco temporale dal 27 dicembre 2020 al 27 dicembre 2021, nel primo trimestre di quest’anno le segnalazioni sono state in tutto 16.441 su un totale di 27.319.001 dosi somministrate, con un tasso di segnalazione di 60,1 segnalazioni ogni 100.000 dosi somministrate, indipendentemente dal vaccino e dalla dose.
Complessivamente, guardando quindi all’intero periodo di osservazione e non solo ai primi tre mesi del 2022, i tassi di segnalazione relativi alla 2a dose sono inferiori a quelli relativi alla 1a e ancora più bassi per la 3a dose. La popolazione esposta alla 4a dose è ancora limitata.
Le segnalazioni gravi corrispondono al 17,8% del totale, con un tasso di 18 eventi gravi ogni 100.000 dosi somministrate. Come riportato nei precedenti Rapporti, indipendentemente dal vaccino, dalla dose e dalla tipologia di evento, la reazione si è verificata nella maggior parte dei casi (72% circa) nella stessa giornata della vaccinazione o il giorno successivo e solo più raramente oltre le 48 ore. Comirnaty è il vaccino attualmente più utilizzato nella campagna vaccinale italiana (65,2%), seguito da Spikevax (24,7%), Vaxzevria (9,0%), COVID-19 Vaccino Janssen (1,1%) e Nuvaxovid (0,02%), in uso dal 28 febbraio 2022. La distribuzione delle segnalazioni per tipologia di vaccino ricalca quella evidenziata nei precedenti Rapporti: Comirnaty 66,5%, Vaxzevria 17,7%, Spikevax 14,5%, COVID-19 vaccino Janssen 1,3%, Nuvaxovid 0,03%.
Per tutti i vaccini, gli eventi avversi più segnalati sono febbre, stanchezza, cefalea, dolori muscolari/articolari, brividi, disturbi gastro-intestinali, reazioni vegetative, stanchezza, reazione locale o dolore in sede di iniezione.
Fascia 5-11 anni. Nella fascia di età 5-11 anni, al 26/03/2022 risultano inserite complessivamente 439 segnalazioni (circa lo 0,3% delle segnalazioni totali) per il vaccino Comirnaty, l’unico attualmente utilizzato in questa fascia di età, con un tasso di segnalazione di circa 21 casi ogni 100.000 dosi.
Il 94% di queste segnalazioni è attribuito alla 1a dose e solo il 6% alla 2a. Circa l’87,2% delle segnalazioni è inserita come non grave e il 12,8% come grave, prevalentemente come “altra condizione clinicamente rilevante”. Non sono presenti segnalazioni di decesso in questa fascia di età.
Gli eventi avversi più frequentemente segnalati per il vaccino Comirnaty in questa fascia d'età, indipendentemente dalla gravità e dal nesso di causalità, sono stati dolore in sede di iniezione, cefalea, febbre e stanchezza. Decessi. Complessivamente, dopo aver verificato la presenza di duplicati, ovvero di casi per cui è stata inserita più di una segnalazione, 879 segnalazioni gravi hanno avuto esito fatale, indicato al momento della segnalazione o come informazione acquisita successivamente al follow-up, indipendentemente dalla tipologia di vaccino, dal numero di dose e dal nesso di causalità.
L’85,1% (748 su 879) delle segnalazioni con esito decesso presenta una valutazione del nesso di causalità con l’algoritmo dell’OMS, in base al quale il 58,4% dei casi (437/748) è non correlabile, il 28,5% (213/748) indeterminato e il 9,5% (71/748) inclassificabile per mancanza di informazioni sufficienti. Complessivamente, 27 casi (3,6%) sui 748 valutati sono risultati correlabili (circa 0,2 casi ogni milione di dosi somministrate), di cui 22 già descritti nei Rapporti precedenti. Le rimanenti 5 segnalazioni si riferiscono a 2 casi di trombosi trombocitopenica a seguito di vaccinazione con vaccino a vettore adenovirale in 2 pazienti per i quali si sono recentemente resi disponibili i documenti clinici per la valutazione; in 3 casi i pazienti sono deceduti a causa di complicanze legate al COVID-19 dopo aver completato il ciclo vaccinale (vaccinazione inefficace).
Nuvaxovid. Il 23 dicembre 2021 è stato autorizzato il vaccino Nuvaxovid (Novavax) basato su piattaforma proteica (proteina spike ricombinante) con l’aggiunta di adiuvante Matrix-M. L’uso effettivo di tale vaccino è iniziato in Italia il 28 febbraio 2022 e al 26 marzo 2022 sono state inserite 47 segnalazioni aventi come sospetto il vaccino Nuvaxovid, tutte riferite a prime dosi, a fronte di un totale di 27.578 dosi somministrate (il tasso di segnalazione di 170/100.000 dosi è da considerarsi con cautela visto il basso numero delle segnalazioni e la minima esposizione della popolazione). Considerato l’esiguo numero di segnalazioni e la bassa esposizione nella popolazione, Aifa sottolinea che al momento non è possibile effettuare delle valutazioni di tipo statistico sui dati attualmente disponibili.
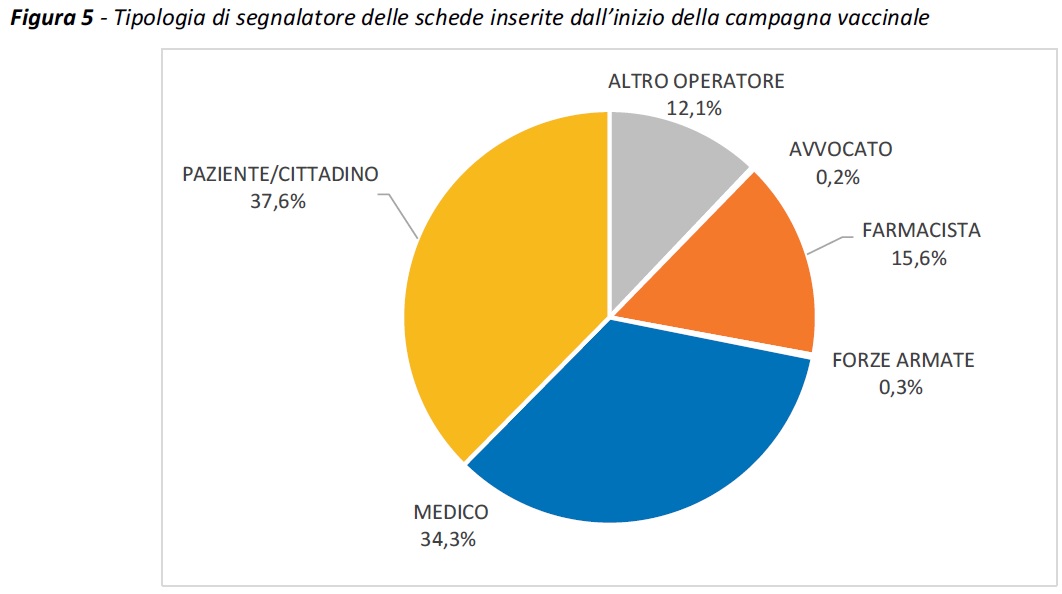
Identikit del segnalatore. Circa il 62% delle segnalazioni proviene da operatori sanitari, prevalentemente medici e farmacisti, mentre circa il 38% da paziente/cittadino, confermando il ruolo preponderante che quest’ultima tipologia di segnalatore sta ricoprendo nella segnalazione spontanea dei vaccini anti-COVID-19.
I Correlati
Gestione del glaucoma e ipertensione oculare: in Italia la nuova combinazione di Santen a dose fissa di latanoprost e netarsudil
Agisce anche sul trabecolato
Studio italiano: ecco perché l’acetilsalicilico è in grado di attivare la risposta del sistema immunitario contro il tumore
La ricerca è stata coordinata dall’Università di Padova e pubblicata su Cancer
Sip: non trascurare vaccinazioni e richiami. Morbillo e pertosse sono sorvegliati speciali
Staiano: “L’incidenza più elevata di morbillo è stata osservata nella fascia di età tra 0 e 4 anni; 11 casi avevano meno di 1 anno di età. Le alte coperture vaccinali sono l’unico strumento di difesa”
Aifa, la carenza di ACE-inibitori in soluzione iniettabile in crisi renale sclerodermica (SRC) non dà rischi per i pazienti
I medicinali a base di enalapril iniettabile non sono disponibili in Italia da oltre vent’anni, in seguito alla revoca dell’Autorizzazione all’Immissione in Commercio (AIC) su rinuncia da parte dell’azienda farmaceutica titolare, nel 2000
Ti potrebbero interessare
Aifa, la carenza di ACE-inibitori in soluzione iniettabile in crisi renale sclerodermica (SRC) non dà rischi per i pazienti
I medicinali a base di enalapril iniettabile non sono disponibili in Italia da oltre vent’anni, in seguito alla revoca dell’Autorizzazione all’Immissione in Commercio (AIC) su rinuncia da parte dell’azienda farmaceutica titolare, nel 2000
Nisticò (Aifa), priorità è evitare carenze di farmaci indispensabili
"Alleanza con le industrie. Italia sia leader nei tavoli che contano"
Aifa, stop alla commercializzazione di Norditropin Nordiflex
Trasferire in modo sicuro i pazienti ad una terapia alternativa con l’ormone della crescita a discrezione dei medici
Presidenza Aifa, Schillaci propone il farmacologo Robert Nisticò
Il nome sarà presentato per l'intesa con le Regioni
Ultime News
Gestione del glaucoma e ipertensione oculare: in Italia la nuova combinazione di Santen a dose fissa di latanoprost e netarsudil
Agisce anche sul trabecolato
Studio italiano: ecco perché l’acetilsalicilico è in grado di attivare la risposta del sistema immunitario contro il tumore
La ricerca è stata coordinata dall’Università di Padova e pubblicata su Cancer
Malattie metaboliche ereditarie: differenti approcci per una visione sistematica sulle patologie
Andrea Pession: “Alcune diagnosi creano più problemi che vantaggi. Lavoreremo ancora di più in rete"
Sip: non trascurare vaccinazioni e richiami. Morbillo e pertosse sono sorvegliati speciali
Staiano: “L’incidenza più elevata di morbillo è stata osservata nella fascia di età tra 0 e 4 anni; 11 casi avevano meno di 1 anno di età. Le alte coperture vaccinali sono l’unico strumento di difesa”









Commenti