Sanofi e Regeneron: cemiplimab ottiene breakthrough therapy dalla FDA

Indicato nel carcinoma cutaneo avanzato a cellule squamose
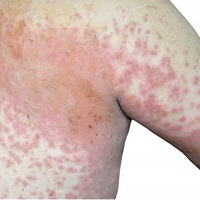
Sanofi e Regeneron Pharmaceutical hanno annunciato che la Food and Drug Administration (FDA) americana ha assegnato la designazione di breakthrough therapy a cemiplimab (REGN2810) per il trattamento di adulti con carcinoma cutaneo a cellule squamose metastatico (CSCC) e di adulti con lo stesso carcinoma localmente avanzato e non asportabile chirurgicamente. Questa forma di carcinoma è il secondo tumore della pelle per mortalità dopo il melanoma
Cemiplimab è un anticorpo monoclonale sperimentale completamente umano, creato per legarsi a PD-1. Proprio in occasione dell’ultima edizione del congresso dell’American Society of Clinical Oncology (ASCO), in giugno 2017, Sanofi e Regeneron hanno presentato risultati preliminari positivi del trattamento con cemiplimab di 26 pazienti con CSCC avanzato in due coorti di espansione di uno studio di fase 1 di circa 400 pazienti.
pubblicità
Il carcinoma cutaneo a cellule squamose (CSCC) è la seconda tipologia di tumore della pelle per frequenza negli Stati Uniti. Nonostante abbia una prognosi favorevole quando diagnosticato precocemente, può rivelarsi particolarmente complesso da trattare in fase avanzata. In questi casi, i pazienti devono subire numerosi interventi chirurgici per rimuovere il tumore dalla testa, dal collo e da altre parti del corpo, risultandone spesso sfigurati. Dopo il melanoma, il CSCC è il principale tumore cutaneo per mortalità.
La designazione di breakthrough therapy ha la funzione di accelerare il processo di sviluppo e l’iter approvativo dei farmaci per patologie gravi o mortali. I farmaci che ottengono questa designazione hanno mostrato solide evidenze di un miglioramento sostanziale di un endpoint clinicamente rilevante rispetto ai farmaci esistenti, oppure rispetto a placebo nel caso non vi siano farmaci disponibili. La designazione include tutte le caratteristiche del fast track, così come una più rigorosa supervisione e confronto con la FDA. La designazione di breakthrough therapy si differenzia dall’approvazione accelerata e dalla revisione prioritaria, che possono anche essere conferite allo stesso farmaco se ne sussistono i criteri specifici Cemiplimab è attualmente in sviluppo clinico. La sua sicurezza ed efficacia non sono state ancora valutate appieno da nessuna autorità regolatoria
I Correlati
Tumore della prostata, nuova combinazione riduce il rischio di progressione
Per i pazienti con forma ormonosensibile metastatica
Quasi un over 65 su tre assume più di 10 farmaci al giorno
Trifirò (Sif): "Serve un cambio di passo: la revisione delle terapie e la de-prescrizione sono parti integranti della buona pratica clinica"
Msd annuncia che lo studio di Fase 3 ha raggiunto l'obiettivo primario in adulti recentemente diagnosticati con ipertensione arteriosa polmonare
Sotatercept entro 12 mesi dalla diagnosi iniziale di IAP, ha dimostrato una riduzione statisticamente significativa e clinicamente rilevante del rischio di eventi di peggioramento clinico rispetto al placebo
Una nuova strategia rende i tumori del colon-retto sensibili all'immunoterapia
Combinando due chemioterapici, i ricercatori sono riusciti a superare il problema che affligge i malati di tumore al colon-retto metastatico, che in oltre il 95% dei casi non rispondono all'immunoterapia
Ti potrebbero interessare
Leo Pharma: via libera dall' AIFA alla rimborsabilità di tralokinumab per gli adolescenti affetti da dermatite atopica da moderata a grave
Negli adolescenti la dermatite atopica è associata a un notevole carico psicologico: maggiore vulnerabilità, rabbia, ansia e insicurezza
Al via “Pausa screening–Ne vale la pelle”: la campagna di sensibilizzazione sulla psoriasi
La campagna promossa da Johnson & Johnson in partnership con APIAFCO – Associazione Psoriasici Italiani Amici della Fondazione Corazza ha l’obiettivo di sensibilizzare la popolazione sulla psoriasi e offrire screening gratuiti
Troppo sale a tavola potrebbe aumentare il rischio di eczema
Lo indica lo studio pubblicato sulla rivista Jama Dermatology e condotto presso l'Università di San Francisco su due ampi campioni di individui
Alopecia areata grave, arriva una nuova terapia specifica
L’assunzione del principio attivo Baricitinib, il primo approvato nel 2022 per i pazienti adulti con alopecia areata grave si è dimostrata ancora più efficace sui pazienti curati nella vita reale rispetto a quelli trattati negli studi registrativi









Commenti