Ranitidina, Aifa ritira il farmaco Zantac

Il prodotto è da 150 mg 20 compresse rivestite con film, codice Aic n. 038486027
Dopo le misure disposte a fine settembre, ritirato un nuovo lotto di un farmaco con ranitidina, per impurità potenzialmente cancerogene. A confermarlo all' Adnkronos Salute è l' Agenzia italiana del farmaco. Si tratta del medicinale Zantac* 150 mg 20 compresse rivestite con film - codice Aic n. 038486027 (tutti i lotti presenti sul mercato, inclusi quelli sottoposti a precedente divieto di utilizzo) della ditta BB Farma Srl, come segnala lo 'Sportello dei diritti'. "A seguito di comunicazioni successive da parte della ditta BB Farma Srl, relative alla presenza di un' impurezza denominata N-nitrosodimetilammina (Ndma), appartenente alla classe delle nitrosammine, riscontrata nel principio attivo ranitidina, l' Agenzia italiana del farmaco (Aifa) ha disposto il ritiro dalle farmacie e dalla catena distributiva", si legge su 'Lo Sportello dei diritti'.
pubblicità
I Correlati
Identificata una terapia per prevenire l'insufficienza renale acuta
Ricerca del San Raffaele di Milano presentata a Belfast
Alzheimer, parere favorevole della Fda per il nuovo farmaco della Eli Lilly
Per casi medio-lievi, rallenterebbe il declino cognitivo del 35%
Antibiotici, contro sepsi efficace la modifica del trattamento
Somministrazione continua invece che multiple e brevi
HIV, in arrivo ulteriori nuovi farmaci a rilascio prolungato, una rivoluzione per i trattamenti
A ICAR 2024, dal 19 al 21 giugno a Roma, focus su hiv e altre malattie sessualmente trasmissibili
Ti potrebbero interessare
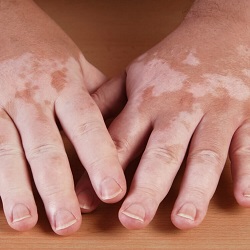
Vitiligine, sì dell'AIFA alla rimborsabilità della prima crema efficace
Il farmaco consente la repigmentazione della pelle dei pazienti sia sul viso che sul corpo
Oltre un nuovo farmaco su tre autorizzato per curare i tumori
Secondo i dati del Rapporto Horizon Scanning di Aifa, sono stati autorizzati 89 nuovi medicinali, di cui 48 contenenti nuove sostanze attive, 8 biosimilari, 23 equivalenti e 10 tra medicinali ibridi
Incontro Aifa-Egualia, Nisticò: Al lavoro per assicurare che tutti i farmaci essenziali siano disponibili per i pazienti italiani
“La lotta al fenomeno delle carenze passa anche attraverso il riconoscimento delle necessità di rendere economicamente sostenibili molti farmaci essenziali. Siamo al lavoro su questo aspetto”
Aifa, la carenza di ACE-inibitori in soluzione iniettabile in crisi renale sclerodermica (SRC) non dà rischi per i pazienti
I medicinali a base di enalapril iniettabile non sono disponibili in Italia da oltre vent’anni, in seguito alla revoca dell’Autorizzazione all’Immissione in Commercio (AIC) su rinuncia da parte dell’azienda farmaceutica titolare, nel 2000
Ultime News
I 30enni di oggi andranno in pensione a 70 anni
Aggiornato il simulatore, per la vecchiaia 67 anni fino al 2028
Dal 2025 le pensioni subiranno un taglio per la Legge Fornero. Ecco come
Il taglio si farà sentire per chi lascerà il lavoro dal gennaio 2025 grazie al meccanismo che adegua i criteri di calcolo dell’assegno ogni biennio sulla base delle aspettative di vita
Sanità: endoprotesi per aneurisma, sperimentazione a Pavia prima in Europa
L'équipe guidata da Antonio Bozzani, direttore della Chirurgia Vascolare del San Matteo, è la prima ad aver contribuito con l'arruolamento di due pazienti, entrambi pavesi di 72 e 85 anni
Di Silverio (Anaao): Luci e ombre del decreto anti liste d'attesa
"Alcune norme rispondono parzialmente alle nostre richieste, altre sono da emendare"









Commenti